近年來,細胞療法為疾病的再生治療帶來了巨大希望。盡管最近在臨床研究方面取得了突破,但將細胞療法應(yīng)用于受傷的大腦并未產(chǎn)生預(yù)期的結(jié)果。
2022年八月中旬,瑞士蘇黎世大學(xué)再生醫(yī)學(xué)研究所在國際期刊《The Neuroscientist》發(fā)表一篇細胞療法在修復(fù)腦部疾病中的文獻,該文獻總結(jié)了干細胞療法在腦部疾病中的局限性,并提出了五項原則來推進干細胞療法的腦再生。文獻側(cè)重表達中風(fēng)的細胞療法,但細胞療法也同樣適用于其他腦部疾病。
干細胞療法修復(fù)大腦損傷應(yīng)注重這五個原則
中風(fēng)是全世界殘疾和死亡的主要原因,目前沒有可用的再生療法。已經(jīng)針對大腦以外的許多疾病領(lǐng)域建立了基于干細胞的療法,并取得了顯著成功。然而,大腦和中風(fēng)病理學(xué)的異質(zhì)性對將臨床前研究的有希望的發(fā)現(xiàn)轉(zhuǎn)化為臨床現(xiàn)實提出了挑戰(zhàn)。在這里,我們確定了五個主要限制,并利用細胞和基因工程領(lǐng)域的最新發(fā)展為解決方案提供了建議(圖1)。
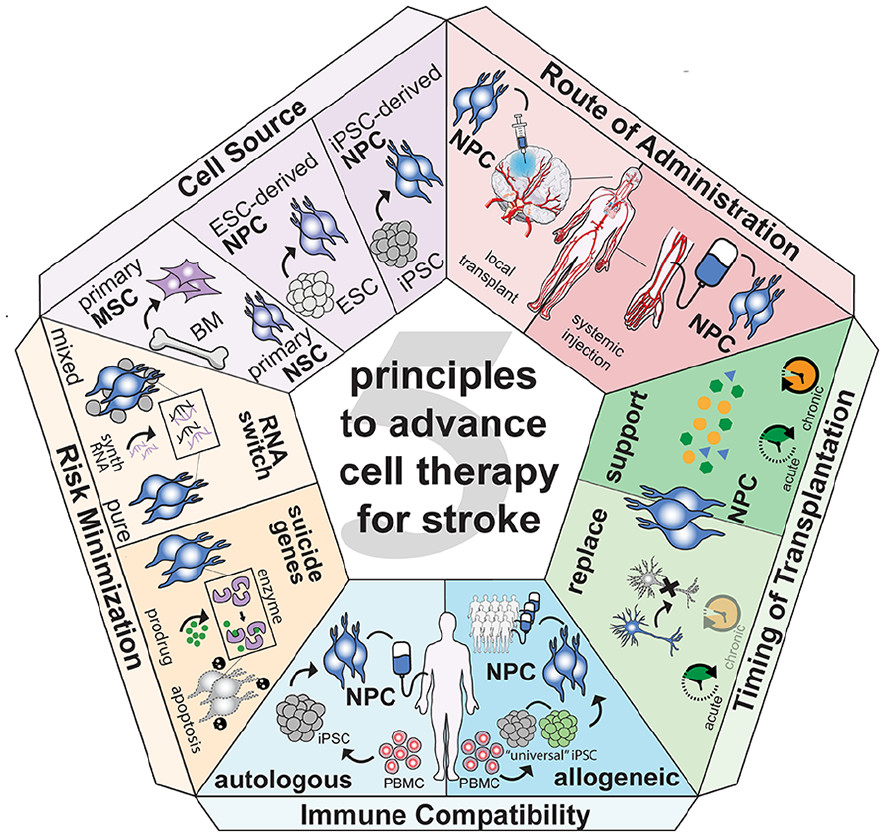
BM=骨髓;ESC=胚胎干細胞;iPSC=誘導(dǎo)多能干細胞;MSC=間充質(zhì)干細胞;NPC=神經(jīng)前體細胞;NSC=神經(jīng)干細胞;PBMC=外周血單核細胞。
第一原則:細胞來源
各種細胞來源被認為可以成功實現(xiàn)腦再生細胞治療,包括成體干細胞、胚胎干細胞或誘導(dǎo)性多能干細胞。然而,所有細胞類型都顯示出其適用性的局限性。
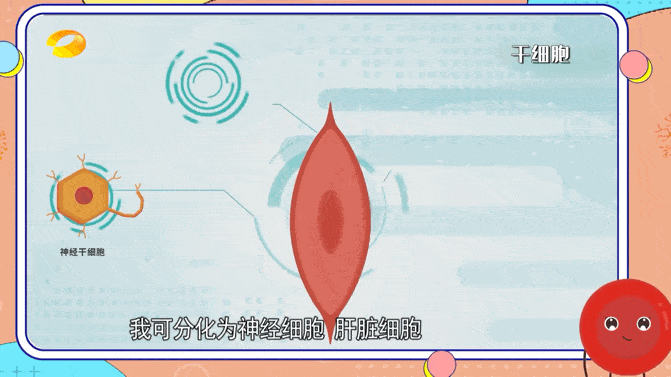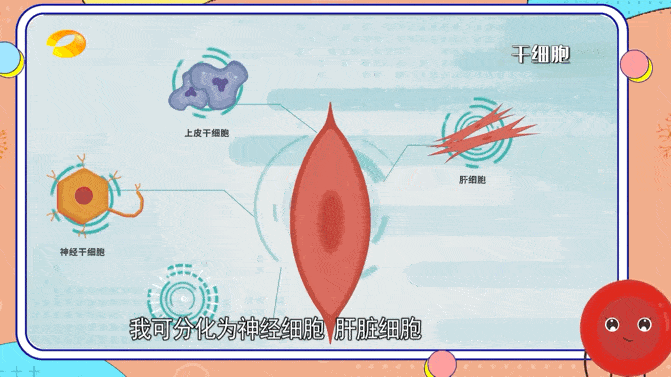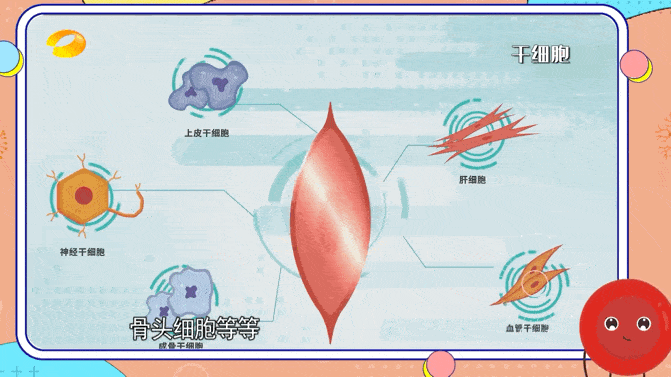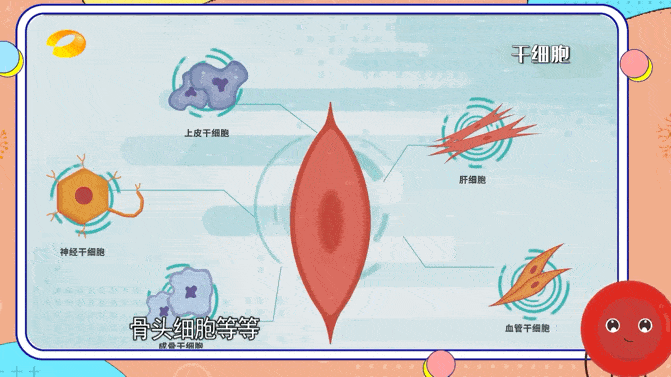
臨床上,最常用的成體干細胞來源是原代間充質(zhì)干細胞,因為它們易于獲取且易于分離。
間充質(zhì)干細胞可能提供營養(yǎng)支持但不分化成神經(jīng)譜系;因此,它們不能用作大腦中的細胞替代療法。原代神經(jīng)干細胞可以整合到受損的神經(jīng)網(wǎng)絡(luò)中,但很難獲得,因為它們通常是從接受癲癇治療神經(jīng)外科手術(shù)的個體的顳葉或腦室下區(qū)提取的。
神經(jīng)干細胞可以來源于流產(chǎn)的胎兒組織,并在永生化后進行克隆擴增。與成體干細胞相比,胚胎干細胞具有更強的分化成多種細胞類型的能力,并且可以無限繁殖。然而,由于需要胚胎,它們受到嚴(yán)重的倫理問題。
隨著iPSC的引入,倫理問題已經(jīng)得到解決。iPSC是通過各種重編程因子的異位表達將體細胞重編程為多能胚胎干細胞樣狀態(tài)而產(chǎn)生的。在移植之前,iPSC通常會分化為所需的神經(jīng)細胞類型,以促進大腦再生。由于具有復(fù)雜樹突的成熟神經(jīng)元不適合細胞移植,因此首選使用神經(jīng)前體細胞。
第二條原則:給藥途徑
如果移植物不能到達受影響的腦組織,那么生成最適合腦再生的細胞源意義不大。盡管目前的臨床前細胞治療研究傾向于大腦局部移植,但超過一半的臨床試驗更傾向于通過全身血液注射來管理細胞。
該領(lǐng)域面臨著一個困境:局部實質(zhì)內(nèi)細胞移植有望獲得最大療效,但注射的相關(guān)風(fēng)險阻礙了其廣泛應(yīng)用。此外,全身注射是微創(chuàng)的;同時,大多數(shù)細胞最終會進入不需要的器官,因此治療效果遠遠達不到預(yù)期的效果。
同時根據(jù)細胞類型、腦損傷的時間和嚴(yán)重程度以及相關(guān)的血腦屏障 (BBB) 損傷而異等,最終移植細胞實際到達大腦中實際數(shù)量也有差異。 在大腦內(nèi),為了確保移植后足夠的細胞數(shù)量到達大腦損傷部位。科研人員開發(fā)了多種聯(lián)合療法。例如,局部移植時,最有利的方法被證明是移植物的水凝膠封裝,它增強了保留和存活,同時改善了移植物的成熟。此外,嵌合抗原受體T細胞治療癌癥的原則, 結(jié)合中風(fēng)相關(guān)肽可以增強損傷部位移植物的歸巢,并在全身應(yīng)用后提供更有針對性和更有效的細胞治療。我們建議未來將細胞輸送到大腦應(yīng)該系統(tǒng)地應(yīng)用,并且可能依賴于細胞對損傷環(huán)境的遺傳或藥理學(xué)功能化,以改善目標(biāo)區(qū)域的歸巢和保留,同時確保注射過程中的低風(fēng)險。然而,最佳目標(biāo)仍有待闡明和臨床前驗證。此外,損傷環(huán)境是高度多變的,并且在腦損傷的急性和慢性階段內(nèi)可能有很大差異。
第三原則:移植的時機
中風(fēng)后的標(biāo)準(zhǔn)臨床程序是通過酶藥物立即恢復(fù)血流。盡管這些程序非常有效,但它們僅適用于少數(shù)中風(fēng)病例,并非所有患者都能取得積極成果。
中風(fēng)后受到撞擊的腦組織在急性期形成一個惡劣的環(huán)境,具有高水平的炎癥、氧化應(yīng)激、細胞死亡和碎屑,這會降低移植物的存活機會。因此,未來細胞治療的最佳治療窗口是在中風(fēng)后幾天到1周開始,以確保移植物的長期存活。對于全身移植細胞來說,因為中風(fēng)可導(dǎo)致雙相BBB打開,并在中風(fēng)后4至6小時和3天增加傳遞率;這個時間窗增加了移植物更有效地滲透到受傷部位的機會。
目前細胞因子釋放和移植物的直接整合已被證明有助于改善急性中風(fēng)后的功能恢復(fù),慢性中風(fēng)后細胞療法的作用機制尚不清楚。在組織丟失和重塑的這個階段,通過細胞替代來增強功能恢復(fù)不太可能由干細胞完成。
然而,神經(jīng)和非神經(jīng)干細胞移植已被證明可以啟動血管生成、改變微環(huán)境、增強突觸活動并促進剩余腦宿主組織中的內(nèi)源性神經(jīng)發(fā)生。所有這些觀察都是基于移植物分泌促進整體功能恢復(fù)的再生和可塑性促進因子的假設(shè)。在這些因素中,血管內(nèi)皮生長因子和腦源性神經(jīng)營養(yǎng)生長因子的釋放已被確定為臨床前和臨床研究中的重要旁分泌機制。
這些研究的一個要點是,在中風(fēng)后的急性和亞急性期,神經(jīng)干細胞療法通過直接替代和營養(yǎng)因子促進功能恢復(fù)。在慢性期,細胞療法的支持作用更可能是改善康復(fù)的主要機制。在決定哪種細胞類型可以為個體患者提供最有效的細胞療法時,這些影響當(dāng)然也很重要。
第四條原則:免疫相容性
免疫排斥是細胞治療中的另一個關(guān)鍵問題。自體iPSC療法(即應(yīng)用從患者自身體細胞生成的 iPSC)可能是規(guī)避此問題的最合適選擇。事實上,第一項將自體 iPSC 衍生的視網(wǎng)膜細胞應(yīng)用于黃斑變性患者的研究并未顯示任何移植物排斥跡象。然而,符合良好生產(chǎn)規(guī)范 (GMP) 的單個iPSC細胞系的生產(chǎn)及其質(zhì)量和安全控制需要付出巨大的努力和巨大的成本,嚴(yán)重限制了其臨床應(yīng)用及用于急性疾病的治療。
京都大學(xué)目前正在進行一項使用同種異體iPSC衍生的多巴胺能前體細胞治療帕金森病的臨床試驗。然而,這種方法需要長期使用免疫抑制劑治療。
因此,科學(xué)家們嘗試能否開發(fā)出具有最高免疫相容性的同種異體iPSCs,這樣便可以實現(xiàn)iPSCs的商品化應(yīng)用。其中一種方法就是利用人類白細胞抗原 (HLA) 對基因進行改造。從而創(chuàng)造出具有克服免疫相容性的iPSC。
間充質(zhì)干細胞因為擁有了低免疫原性,以及對各類免疫細胞,如T淋巴細胞、B淋巴細胞、NK細胞、Treg細胞等增殖、活化的抑制,實現(xiàn)了自帶“免疫豁免”的屬性,徹底清掃了MSC異體應(yīng)用可能出現(xiàn)免疫排斥的,自身或者外在的風(fēng)險,實現(xiàn)臨床應(yīng)用MSC的安全性。在臨床上具有十分廣闊的前景。
第五原則:風(fēng)險最小化
基于細胞的再生療法并非沒有風(fēng)險。因此,移植前后的安全措施至關(guān)重要。風(fēng)險范圍包括急性腦出血(在立體定向局部注射時)、細胞凝血或細胞誘發(fā)的栓塞(全身注射時)和功能性副作用(如癲癇發(fā)作和不自主運動)。從長遠來看,最大的擔(dān)憂是移植細胞形成惡性腫瘤以及移植細胞在不需要的組織中沉積。為了最大限度地降低這些風(fēng)險,實現(xiàn)風(fēng)險最小化,未來必須對細胞來源質(zhì)量控制、細胞移植方案、注射細胞數(shù)量和注射途徑等進行深入探索,并建立規(guī)范化流程。
結(jié)論
綜上所述,我們認為在可預(yù)見的未來,中風(fēng)的細胞療法具有增加患者治療選擇的巨大潛力。全身和急性移植物注射最有希望成為適用于一系列中風(fēng)患者的有效細胞療法。目前正在開發(fā)遺傳和藥理學(xué)工具,以確保精確定位到大腦的受傷區(qū)域。總之,中風(fēng)的細胞療法前途無限,相信隨著細胞療法進一步改善,未來腦卒中問題能被解決。
參考文獻:Rust R, Tackenberg C. Stem Cell Therapy for Repair of the Injured Brain: Five Principles. The Neuroscientist. 2022;0(0).



 掃碼添加官方微信
掃碼添加官方微信